近日,天昊生物CNVplex®高通量DNA拷贝数检测技术助力蛋白质组学国家重点实验室,北京蛋白质组研究中心周钢桥教授和贺福初院士课题组,在著名胃肠病学杂志Gastroenterology(IF:20.773)上发表了题为“Germline Duplication of SNORA18L5 Increases Risk for HBV-related Hepatocellular Carcinoma by Altering Localization of Ribosomal Proteins and Decreasing Levels of p53”的研究。研究团队基于CNV的全基因组关联研究(GWAS)发现染色体15q13.3位点的扩增(15q13.3 duplication)增加了乙肝病毒相关的肝细胞癌(HBV-related HCC)患病风险,而该位点的小核仁RNA(snoRNA) SNORA18L5促进了HCC的发生发展,并从机制上逐步深入分析了SNORA18L5参与的促进HCC形成的过程,以下是这篇文章的具体内容。
文章题目:Germline Duplication of SNORA18L5 Increases Risk for HBV-related Hepatocellular Carcinoma by Altering Localization of Ribosomal Proteins and Decreasing Levels of p53
期刊:Gastroenterology (IF:20.773)
接收时间:2018年4月19日
发表时间:2018年8月
研究背景
很多证据表明遗传因素能够影响乙肝病毒相关肝细胞癌(HBV-related HCC)的易感性,现有的研究主要基于SNP的全基因组关联研究(GWAS)分析HCC的遗传风险。除了SNP之外,CNV也与多种常见疾病有关联,然而针对germline水平的CNV和HBV-related HCC并没有相关的GWAS分析。因此本研究在中国人群中基于CNV的多阶段GWAS分析拷贝数变异是否会影响HBV-related HCC的风险。
GWAS研究思路及主要结果
1. GWAS研究结果及分析:
GWAS发现阶段,利用先前研究的芯片数据分两步策略寻找CNV的关联:确定的常见拷贝数多态性(CNPs)+新的未被确定的CNV分型,最后确定14个CNV位点与HBV-related HCC显著相关(图1)。
验证阶段,首先利用天昊生物CNVplex®技术对14个CNV位点进行验证,结果发现仅一个CNV,低频的15q13.3位点的扩增(15q13.3 duplication)与前期结果一致(图2A)。然后利用qPCR技术在独立的三组实验中分别验证该位点的拷贝数,重复性均较好。结合五个阶段的case-control分析,15q13.3位点的扩增在case和control中的频率分别为2.3%(36/1562)和0.2%(3/1533),与HBV-related HCC显著相关(p = 3.17×10-8,OR = 12.02)。
然后需要确定15q13.3 duplication是否为可遗传的变异,利用芯片对205个家系进行研究发现,其中6个后代存在15q13.3位点的重复,而且均遗传自他们的父母,表明了该位点的可遗传性。
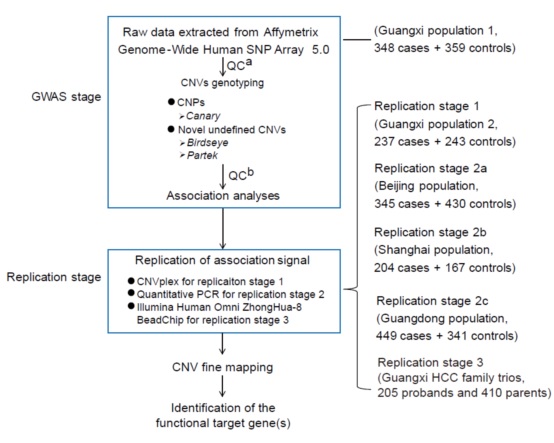
图1 GWAS发现阶段及验证阶段研究策略
研究人员利用原位杂交证实了15q13.3 duplication的存在(图2B),而且多个数据库的结果也验证了这个位点在case和control中的突变频率与现有结果一致(图2C)。
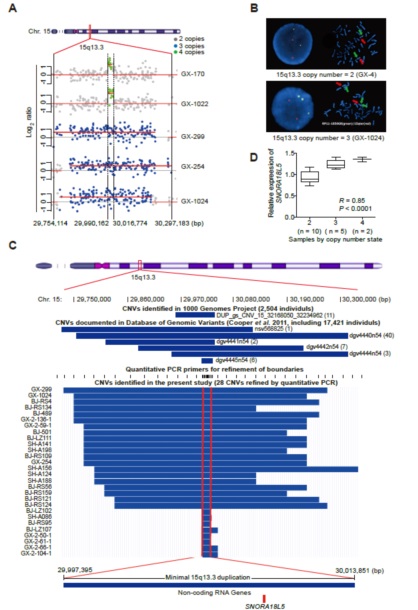
图2 15q13.3 duplication基因组定位
2. 15q13.3 duplication的精细定位及基因确定
结合数据库和qPCR结果将15q13.3 duplication精细定位在最小为15.4 Kb的区域(29,997,395-30,012,769 bp),但是该区域中并没有蛋白编码基因,而是有一个小的核仁RNA(snoRNA) SNORA18L5(图2C)。qPCR结果显示在单核细胞样本中SNORA18L5表达水平与其germline水平的拷贝数呈正相关(R = 0.85,p < 0.0001,图2D),SNORA18L5是15q13.3 duplication区域一个合适的候选基因。
3. SNORA18L5基因表达和功能初探
与对照细胞或非瘤组织相比,SNORA18L5在多种HCC细胞系或组织中均表达上调(图3A)。进一步发现SNORA18L5启动子区域存在较高水平的H3K4me3修饰,两者存在正相关(图3B,3C);使用MLL抑制剂处理HepG2细胞的时候,H3K4me3的富集及SNORA18L5表达水平均会下降(图3D)。而且高表达的SNORA18L5与高AFP水平、较大的肿瘤尺寸、较晚TNM分期、微血管侵入均有显著相关性(图3E);SNORA18L5高表达的HCC患者预后更差(图3F)。这些结果进一步说明SNORA18L5可能是15q13.3 duplication的一个功能基因。
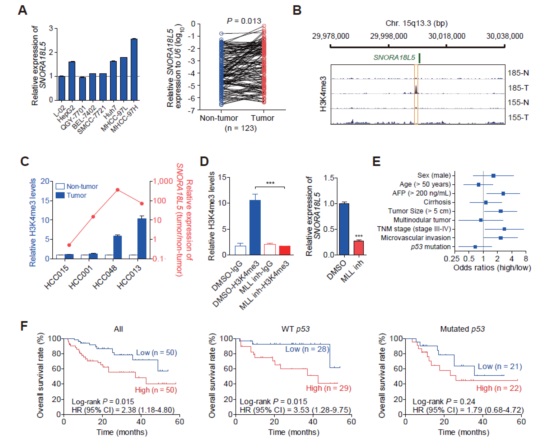
图3 SNORA18L5上调受组蛋白修饰调控并且与HCC较差预后相关
4. SNORA18L5通过加速G1/S期转变及抑制凋亡从而促进HCC细胞生长
在L-02和HepG2细胞中过表达SNORA18L5后显著增加细胞增殖和菌落形成(图4A,4B),in vivo结果也显示过表达后肿瘤体积的增大(图4C)。细胞周期分析发现过表达的SNORA18L5加速G1/S期转变(图4E),而且在H2O2处理HCC细胞后显示出抗凋亡的影响(图4F)。
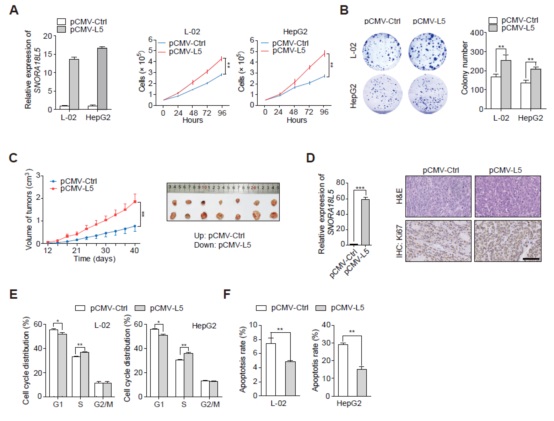
图4 SNORA18L5促进HCC肿瘤形成
5. SNORA18L5详细调控机制
SNORA18L5过表达的细胞中成熟的18S和28S rRNAs水平显著更高(图5C),核糖体的合成也显著增加(图5E),而且在Act.D处理的细胞中过表达SNORA18L5能够显著减弱rRNA加工缺陷(图5D)。因此SNORA18L5的出现能够通过促进rRNA成熟从而减弱核糖体合成的压力。
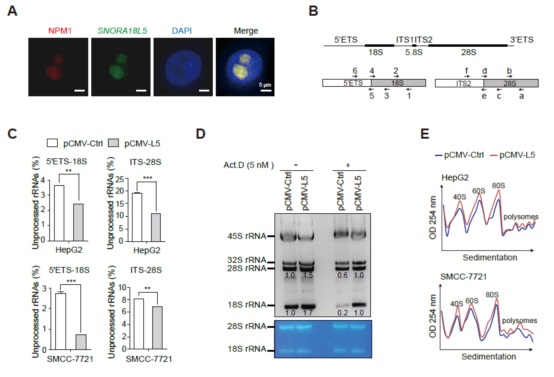
图5 SNORA18L5通过促进rRNA成熟从而减弱核糖体合成的压力
因为核糖体合成的缺陷会导致p53较稳定的状态并且诱导基于p53对细胞增殖的抑制,因此团队针对SNORA18L5和p53之间的关系进行研究,发现SNORA18L5的存在抑制p53积累,依赖p53起到oncogene的作用。最后还发现SNORA18L5通过维持RPL5和RPL11两种核糖体蛋白(RP)在核内来调控MDM2,SNORA18L5又促进MDM2调控的p53泛素化和降解(图6,详见参考文献)。
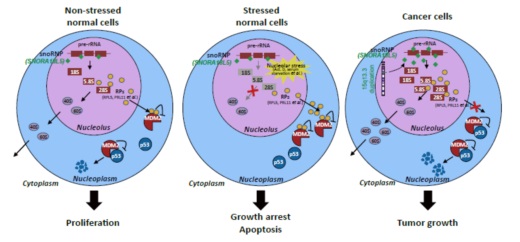
图6 SNORA18L5在HCC肿瘤发生过程中的功能模型
结论
在中国人群中基于多阶段germline CNV的GWAS研究发现一个低频的15q13.3 duplication与HBV-related HCC的易感性相关,而且验证了SNORA18L5作为这个风险的CNV的靶点,通过促进rRNA的成熟,减弱核糖体合成压力-RPs-MDM2-p53信号通过实现其oncogene的功能。
特别感谢
天昊生物特别感谢蛋白质组学国家重点实验室,北京蛋白质组研究中心周钢桥教授和贺福初院士课题组对天昊生物技术和服务的认可!天昊生物将长期致力于为分子生物学及医学遗传学领域的研究者提供高质量的科研策略咨询、实验技术服务和遗传数据分析,帮助广大科研人员获得更为优质的科研成果!
本成果参考文献
Cao P, Yang A, Wang R, Xia X, Zhai Y, Li Y, Yang F, Cui Y, Xie W, Liu Y, Liu T, Jia W, Jiang Z, Li Z, Han Y, Gao C, Song Q, Xie B, Zhang L, Zhang H, Zhang J, Shen X, Yuan Y, Yu F, Wang Y, Xu J, Ma Y, Mo Z, Yu W, He F, Zhou G, Germline Duplication of SNORA18L5 Increases Risk for HBV-related Hepatocellular Carcinoma by Altering Localization of Ribosomal Proteins and Decreasing Levels of p53, Gastroenterology (2018), doi: 10.1053/j.gastro.2018.04.020.