
Stanford大学William Greenleaf教授,ATAC-seq领域开创者之一
个人主页:http://greenleaf.stanford.edu/index.html
虽然名字叫“Greenleaf (绿叶)”,但是William Greenleaf教授在表观调控研究领域,绝对是“红花”级人物。自该课题组在2013年Nature Methods上发表第一篇ATAC-seq (assay for transposase-accessible chromatin using sequencing)技术性文章(Transposition of native chromatin for fast and sensitive epigenomic profiling of open chromatin, DNA-binding proteins and nucleosome position)以来,有关染色质开放程度及表观调控相关的研究就火了起来。Greenleaf教授于2019年1月在Nature Reviews Genetics上发表了综述性文章,系统总结了染色质可及性和调控表观组学研究进展。

DNA的物理可接近是染色质高度动态过程,在建立和维持细胞特征方面发挥着重要作用。基因组可接近染色质的组织形式反映了可能的物理性相互作用网络。在这个网络中,增强子、启动子、绝缘体和染色质结合因子共同作用,调节基因表达。这种可及性情况会随着外部刺激和发育的变化而动态变化。新的证据表明,可及性的稳态维持本身是通过染色质结合因子和核小体之间的竞争相互作用来动态调节的。在这篇综述中,作者总结了如何检测可接近基因组方法,并探索转录因子在启动可接近性重塑中的作用;本文目标是阐明染色质可及性如何诠释基因组中的调控元件,并探讨这些表观遗传学特征如何动态建立并控制基因表达的。
名词解释:
Chromatin-binding factors: Non-histone macromolecules that bind either directly or indirectly to DNA.
Transcription factor (TF): A non-histone protein that directly binds to DNA.
Architectural proteins: Proteins that have a structural role in organizing chromatin, including linker and core histone proteins, as well as insulator proteins.
Nucleosome occupancy: The fraction of time that a particular sequence of DNA is bound by the core histone octamer.
Epigenetic canalization: A set of persistent epigenetic features (alternatively, the process of establishing this feature set) that molecularly defines a cell type and comprises a continuum of cellular states including cell cycle phases and active
tion states.
TF footprinting: High-resolution analysis of chromatin accessibility data to identify a local accessibility signature in the neighborhood of putative binding sites for a particular transcription factor (TF). This signature reflects the size and binding mechanism, as well as other biophysical properties, of a TF.
Nucleosome turnover rates: The rates at which nucleosomes disassemble at particular genomic loci; alternatively, the inverse of the nucleosome residence times.
Poised enhancers: Inactive enhancers that do not regulate gene expression but share a subset of epigenetic features commonly observed at active enhancers, including histone H3 lysine 4 monomethylation (H3K4me) and accessibility.
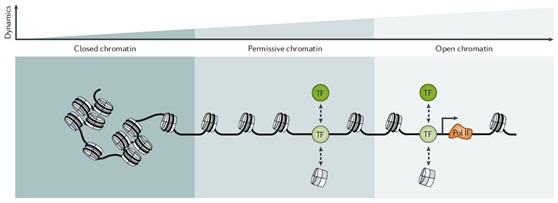
图1、可接近状态反映基因组中染色质动态的分布。与封闭染色质(closed chromatin)相反,宽松染色质(permissive chromatin)对于转录因子来说是足够动态的,可以启动序列特异性的可及性重塑并建立开放染色质(open chromatin)构象。Pol II:核糖核酸聚合酶II;TF:转录因子。
染色质可及性(Chromatin accessibility)是核内大分子能够物理接触染色质化DNA的程度,由核小体的占据和拓扑结构以及阻碍DNA可及性的其他染色质结合因子决定(图1)。虽然可接近的基因组占总DNA序列的约2-3%,但却含有90%以上TFs的结合区域。TFs与组蛋白和其他染色质结合蛋白动态竞争,以调节核小体占据率并促进对局部DNA的接近。染色质可及性反映了TF结合和遗传位点总的调节潜力。这种观点为追踪决定细胞状态的转录调控因子差异结合的可及性变化奠定了分析基础。
检测染色质可及性常用方法
最近的技术进步极大地拓宽了染色质可及性检测的应用范围,将样本需求降低到临床的水平,并提高了这些分析的鉴定能力,以识别单细胞和单分子分辨率下的调控结构域(图2)。
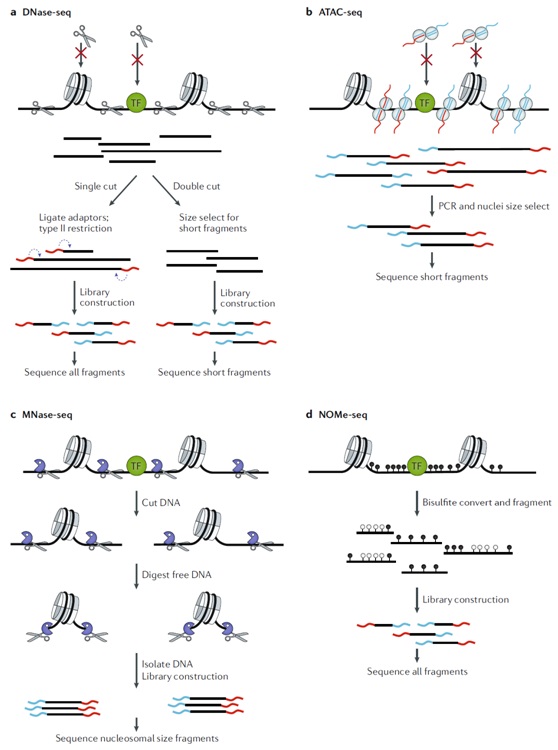
图2、检测染色质可及性的主要方法。a)DNase-seq:脱氧核糖核酸酶I超敏位点测序(DNase I hypersensitive site sequencing),使用内切脱氧核糖核酸酶在可接近的染色质内切割DNA。内切核酸酶在蛋白质结合位点切割效果被大大削弱(红色十字表示切割阻断)。b)ATAC-seq:转座酶可及染色质测序(Assay for transposase-accessible chromatin using sequencing),使用超活性转座酶(Tn5)同时切割并将adaptors连接到可及DNA上并测序。c)MNase-seq:微球菌核酸酶测序(Micrococcal nuclease sequencing),使用内切核酸酶/外切酶MNase切割和除去可接近的DNA并测序。d)NOMe-seq:核小体定位及甲基化组测序(Nucleosome occupancy and methylome sequencing),使用GpC甲基转移酶来甲基化可接近的DNA。亚硫酸氢盐将非甲基化胞嘧啶转化为尿嘧啶核苷酸后的DNA并测序。
DNase-seq:利用DNase切割之后测序的方法来量化基因组中DNase敏感染色质的相对丰度。可以使用II型酶进行单次切割后进行建库测序的,也有使用双次切割后选择合适大小片段建库测序。单次切割方法可以识别更容易接近的位置,而双次切割工作流程更简单,可以得到更高信噪比数据(图2a)。
ATAC-seq:利用超活性转座酶Tn5切割染色染后测序。目前ATAC-seq已经被广泛采用,重要原因是该方法技术稳定性好,操作简单快速,并且适用于临床和初级组织等样本有限的情况。ATAC-seq文库通常可以在不到2小时内可以用10000-20000个细胞(已有报道使用少至500个细胞)构建;相比之下,DNase-seq通常需要数十万个细胞和几天才能完成。
MNase-seq:利用微球菌核酸酶MNase来切割并测序。该技术可以鉴定组蛋白在调控染色质可及性中的作用。MNase既可以利用内切酶活性切割核小体间DNA,也作为外切酶活性降解未受蛋白质保护的切割产物DNA。
NOMe-seq:利用来自M.CviPI的GpC甲基转移酶MTase,通过化学修饰而不是切割可接近的DNA来探测染色质可接近性。由于该酶可以对不受核小体或与染色质紧密结合的其他蛋白质保护的GpC二核苷酸(GpCm不出现在人类基因组中,因此没有GpCm的内源性背景)在GC处产生特异甲基化。由于在整个基因组中GpC的频率很高,因此NOMe-seq可以同时检测DNA的可及性和甲基化状态,且不存在富集偏差和单分子特征。
单细胞可及性方法
单细胞可及性变化的测量有望揭示基因组调控的一个核心问题:短时间波动和染色质可及性的发育变化是如何在整个基因组中协调的?基于ATAC-seq、DNase-seq和NOMe-seq文库制备方案,已经开发了多种方法来测量单细胞染色质可及性。
组合式标签为成千上万个单细胞ATAC-seq的建库提供了一种优秀的条形码策略。在这种方法中,用独特的条形码Tn5酶对纯化的细胞核进行多次转座反应,然后在有限稀释度下混合进行多重标签PCR反应。
单细胞ATAC-seq可以通过捕获单细胞微流体装置(Fluidigm,C1)或纳米孔芯片(Takara Bio,ICELL8)来实现。最近,单细胞ATAC-seq也已经在10X Genomics和Bio-Rad的基于液滴的微流体平台上实现。早期的报告表明,这些高通量平台将提供与纳米孔捕获技术类似的数据质量。
染色质可及性图谱解读
最近对单分子和单细胞可及性的检测表明,对细胞群体的可及性检测代表不同分子状态的整体平均值(图3)。当观察一个潜在的、动态的、不同步的过程时,这种分子异质性自然会出现。例如,在转录位点,RNA聚合酶及其他TF一起,置换TSS上游的核小体,并移动启动子下游位置良好但不稳定的核小体(图3a )。对单分子NOMe-seq数据的足迹分析揭示了这一过程,随着转录过程的展开,捕捉每个分子状态(图3b)。尽管会受采样效率的影响,但是单细胞可及性检测与对整个基因组调节区域的预测得到相似的分子异质性结果(图3c)。
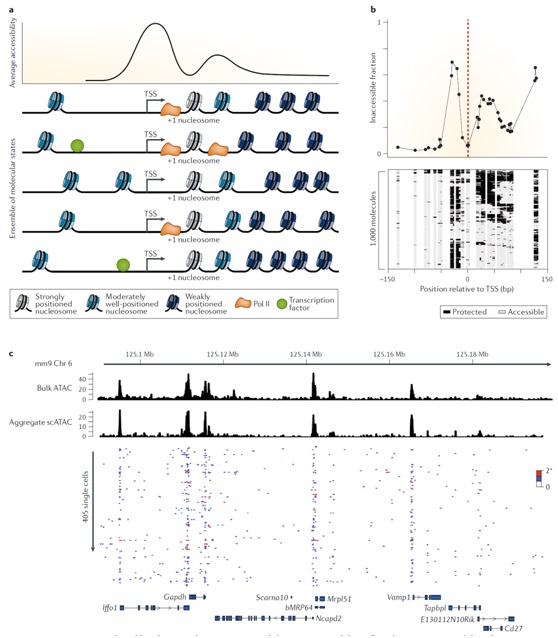
图3、染色质可及性的群体尺度测量反映了单分子异质集合的平均可及性。a)转录活性启动子和基因主体的可及性表明异质分子构型的集合决定了群体染色质可及性分布。b)转录起始位点(TSSs)可及性的单分子测量反映了结合蛋白对DNA的不同保护作用。c)单细胞ATAC-seq测量持家基因位点的可及性,显示DNA对转座酶切的异质敏感性。
染色质可及性最近被用来鉴定全基因组关联研究(GWAS)产生的因果遗传变异。人类基因组中的大多数单核苷酸多态性(SNPs)出现在非编码和基因间的基因组区域,并对复杂性状单独产生小的或间接的影响,从而影响因果变异检测。最近,一些研究利用染色质可及性来更好地理解这些非编码SNPs及其对性状的影响。例如,Maurano等人研究表明,许多因果GWAS变异集中在非编码DHSs(DNase hypersensitivity sites)中,并且可以通过使用染色质可及性数据更准确地与它们影响的基因联系起来。这些结果强调了将染色质可及性数据与功能和其他表观遗传学数据分析相结合的价值。
可及性的生物物理决定因素
在真核生物基因组中,对染色质化DNA的物理接触受到不同长度尺度的调控,并且很大程度上取决于核小体和DNA相关大分子的组织和占据,包括TFs和结构蛋白。DNA几乎普遍被组蛋白或其他DNA结合因子结合,尽管这些因子在TF长度尺度上局部阻断DNA结合,但非抑制因子对DNA的竞争往往会增加核小体长度尺度上的可及性。TF结合与可及性相关的原因可能是多种原因造成的。首先,包括TFs和聚合酶等DNA结合蛋白的足迹通常远小于核小体占据的约146 bp。因此,与完整核小体相比,非组蛋白结合使DNA更容易接近。第二,分子间的相互作用基本上是随机的,非组蛋白与DNA复合物的平均停留时间通常比核小体周转的时间更短,因此可以更频繁地接触未结合的DNA。最后,序列依赖性结合蛋白与DNA的非特异性染色质重塑提供了一种补充底物,这种重塑通常通过去除或重新定位核小体来进一步打开近端染色质。考虑到这些因素,组蛋白的线性和拓扑结构在启动DNA获取方面都有着巨大的作用。
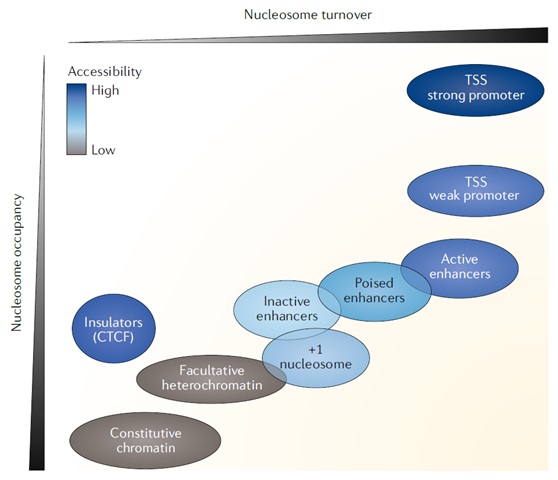
图4、核小体周转率和占据率在大尺度基因组区域内呈反比关系。易接近的染色质在高核小体周转率的基因组区域内富集,也与密集核小体占据一致。
染色质可及性重塑
对染色质化DNA的物理接触是随着外部刺激和发育阶段而动态变化的。染色质的可及性在整个基因组中受到多种因素调控。TFs在这一过程中必然起着中心组织作用,因为重塑机制的其他组成部分很大程度上不提供DNA序列特异性。然而,绝大多数被检测的TFs只与可接近的核小体耗尽的DNA结合;这种生物物理限制的典型例子是热休克因子,在核心组蛋白存在的情况下,热休克因子不能结合到它的同源DNA靶上,而是依赖于热休克启动子无处不在的可及性来快速诱导反应基因。因此,TFs如何与封闭染色质相互作用以提供序列特异性可及性重塑的机制问题仍然是一个深入研究的课题。这里研究者提出几个工作模型解释了TFs和活跃核小体重塑子的协同作用是如何建立和维持可及性状态的(图5)。
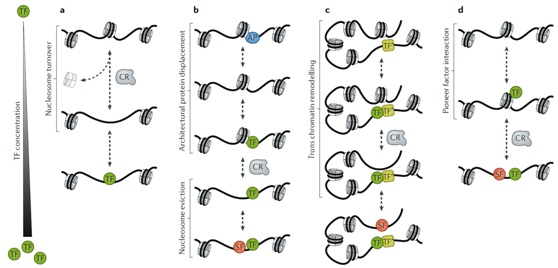
图5、染色质可及性重塑模型。a)转录因子(TFs)通过与动态核小体(以浅灰色显示)的被动竞争引发可及性重塑。核小体的周转动力学受局部DNA序列、组蛋白组成和特定染色质重塑子(CR)活性的调节。TF结合位点的被动竞争可能涉及核小体滑动或驱逐。b)与活性染色质重塑子一起,TFs置换瞬时结合到非核小体模板上的结构蛋白(APs),以启动顺式核小体驱逐。活性核小体位移通过与新获得的DNA结合的次级转移因子来稳定。c)激活的TF与组成性可获得的增强子结合,并通过招募活跃的染色质重塑子和稳定次级TFs (SFs)来介导核小体驱逐和可及性重塑。d)先锋转录因子与核小体DNA结合,并独立或与活跃的染色质重塑子一起直接打开染色质。核小体驱逐后次级TFs的结合稳定了新建立的可及性状态。
结论和未来发展方向
染色质可及性是通过组蛋白、TFs和活性染色质重塑者之间的动态相互作用建立的。核小体的占有和定位是可及性的主要决定因素,并受到序列特异性TFs和染色质重塑子的调控。这种相互作用是通过亚组蛋白规模的TFs对核小体DNA的直接竞争或者通过招募活跃的染色质重塑子来动态驱逐核小体来实现的。核小体不仅仅是一个压抑的单位,而是染色质调控景观的中心组成部分。未来几年,新的单分子和单细胞方法将会揭示这一模式的生物物理和功能含义。
染色质状态和功能之间存在着复杂的相互作用,一个例子涉及增强子和启动子可及性的转录影响;尽管两者对于转录都是必需的,并与活性相关,但转录沉默基因的非活性增强子和启动子通常是开放的,这表明染色质可及性对于增强子或启动子活性是必需单不充分的。这些稳定的增强子和启动子是可接近的,但缺乏活性调节区的明确标记,包括增强子RNA (eRNA )生成和组蛋白乙酰化。另一个可及性和转录活性不一致的例子是在发育中的黑腹果蝇的合子基因激活期间:尽管激活前在早期胚胎中观察到染色质的广泛开放,但是许多可及性基因在转录上是不活跃的,直到发育后期。
直到最近,由于大量的材料需求,临床样本在很大程度上难以进行表观遗传学分析。然而,小规模染色质可及性分析的进展预示着广泛的临床影响,特别是对于理解复杂的疾病状态,如造血致癌和免疫衰竭。最近对皮肤T细胞淋巴瘤的研究揭示了癌基因失调的易接近性特征和治疗干预的表观遗传学含义。整合单细胞表观遗传学和转录测量,包括最近关于单细胞转录和染色质可及性测量的报告,将进一步拓宽人们对疾病表观遗传学基础的理解和表观基因组学的临床应用空间。
染色质可及性代表了表观基因组的功能,定义了整个基因组中一系列假定的调控区域。增强子、绝缘体、启动子和基因体之间开放染色质的组织提供了一个可延展的生物物理模板,染色质表观基因组的成分通过该模板相互作用。了解这些调控域是如何随着细胞在发育阶段和细胞激活状态之间的转变而动态建立的,以及调控元件如何塑造基因表达程序的生物物理规则,将是未来几年表观遗传学研究的一个重要焦点。
原文网址:https://www.nature.com/articles/s41576-018-0089-8
关于天昊
天昊生物具有多年基因组、转录组和表观组检测与分析经验,可以为用户提供多层次、全方位、一站式专业服务,期待成为您多组学测序分析的优质服务提供商!