英文题目: The microbiota programs DNA methylation to control intestinal homeostasis and inflammation
中文题目:肠道菌群重塑肠上皮细胞DNA甲基化以控制肠道稳态和炎症
期刊名:Nature Microbiology
影响因子:14.3
发表时间:2020年2月
单位: 以色列希伯来大学医学院
研究摘要:
尽管已经对肠道微生物的多样性进行了大量的研究,但对其在正常和致病条件下如何影响肠道内稳态的研究还很少。表观遗传学机制最近被认为是在微生物群和肠上皮细胞(IEC)基因组之间相互交流的介质。我们对常规饲养和无菌小鼠进行了全基因组亚硫酸氢盐测序( WGBS ),发现暴露于共生微生物群会导致调控元件的局部DNA甲基化改变,这种改变是依赖于去甲基化酶TET2/3的,这最终激活了一组“早期前哨”反应基因,以维持肠道内稳态。此外,我们还证明,葡聚糖硫酸钠诱导的急性炎症暴露于微生物群会导致调节元件的DNA甲基化和开放染色质的变化,从而导致结肠炎和结肠癌相关功能基因表达程序的改变。最后,通过基因干预,我们证明了微生物群诱导的表观遗传重塑对于维持体内肠道内稳态是必要的。
研究背景:
DNA甲基化是一种化学标记系统,通过影响蛋白质结合和染色质结构,引起基因表达的变化,来注释遗传信息。表观遗传学机制最近被认为是在微生物群和肠上皮细胞(IEC)之间相互交流的介质,并且在炎症性肠病(IBD)的发病机制中起着关键作用。肠道炎性疾病会引起许多与健康有关的问题,并降低生活质量。全基因组相关研究已将160多个遗传易感位点与IBD联系起来,然而这些基因座中的绝大多数以低优势比(1-1.15)促进疾病的发展,这表明基因组遗传对IBD的贡献更为有限。此外,对同卵双胞胎的实验显示,成对内IBD的一致性低于50%,因此人们普遍认为环境因素可能在IBD的发生发展过程中起重要作用,在正常发育和疾病发病过程中涉及表观遗传机制,如组蛋白修饰和DNA甲基化。肠道微生物群通过改变宿主基因在整个肠道中的表达来调节肠道生理,但其潜在的机制尚未阐明。先前发表的全基因组组蛋白修饰分析表明,微生物群调节了几个肠细胞免疫亚群的染色质谱。我们现在分析了正常和急性炎症条件下共生细菌对小鼠肠上皮细胞(IEC)表观遗传DNA甲基化谱的影响。
研究结果:
微生物群诱导的基因表达变化
为了确定共生菌群对肠道上皮细胞宿主基因转录的影响,分析了从小鼠结肠隐窝分离的肠上皮细胞(IECs)的mRNA转录组,比较了在没有微生物的情况下出生后饲养的无菌(GF)小鼠与在有微生物的情况下出生后饲养的年龄和性别匹配的常规(CNV)小鼠。数据分析显示免疫基因表达无普遍差异,FACS分析显示,在结肠隐窝IECs的制备过程中,免疫细胞的贡献较低,说明免疫细胞的浸润可忽略不计。主成分分析显示三个常规(CNV)小鼠与三个无菌(GF)小鼠之间有很大的相似性。差异基因表达分析发现,在CNV和GF样本中,有824个基因显著上调,358个基因下调,表明有大量基因表达被微生物调控。358个下调基因的GO功能分析显示细胞外基质和代谢过程富集。824个上调基因的通路分析显示,参与有丝细胞分裂的基因显著富集,与先前公布的数据一致,表明无菌(GF)小鼠肠细胞的隐窝更新率减弱。与这一发现一致,常规(CNV)小鼠隐窝中增殖标记物的表达水平显著增加。总之,研究结果清楚地表明,肠上皮细胞(IECs)暴露于细菌中对肠道上皮细胞生物学的多个方面都有显著影响。
微生物群导致调控元件的表观遗传深刻变化
为了确定微生物群对宿主全基因组DNA甲基化的影响,我们对结肠隐窝肠上皮细胞(IECs)进行了全基因组亚硫酸氢盐测序(WGBS),数据分析显示,与无菌(GF)小鼠相比,常规(CNV)小鼠样本中的整体甲基化水平显著降低(图1a)。还比较了启动子和峡谷(发现人基因组中,存在保守的、大范围的低甲基化区域,泛癌超高甲基化的峡谷区与基因激活显著相关)的甲基化水平,这两个调控特征通常与基因的5'区域相关,并确定了轻微但可重复的甲基化变化。我们在数据集中识别了低甲基化区域(LMRs,代表基因调节活跃区域)。CNV样本包含约93000个低甲基化区域(LMRs),而GF样本仅包含约57000个低甲基化区域(LMRs)。进一步分析发现,从CNV小鼠分离的结肠隐窝IECs中12983个LMRs的甲基化水平降低(指定为低甲基化LMRs,hypomethylated LMRs),而只有3115个LMRs的甲基化水平升高(指定为高甲基化LMRs,hypermethylated LMRs)(图1b)。我们还通过对来自其它小鼠的GF和CNV结肠隐窝DNA以及FACS分类的IECs进行靶向亚硫酸氢盐分析来验证我们的WGBS数据,两个结果是相似的。我们的研究结果表明,暴露在微生物群中会引起诸如LMRs等调控元件的深刻表观遗传变化。
由于LMRs往往使DNA甲基化变化与基因表达变化重叠,我们将重点放在基因内LMRs上,它允许将单个LMRs分配给特定的基因,我们发现大多数与基因表达改变相关的LMRs都处于低甲基化(hypomethylation)。我们进一步关注那些在CNV小鼠中变得低甲基化,并且表现出显著表达增加的300个LMRs(图1c),结果发现这些低甲基化LMRs高度显著富集在三个转录因子家族(FoxA、Eklf和AP1)的结合位点,这表明这组转录因子参与整合微生物群相关信号(图1d)。事实上,FoxA和Eklf转录因子在肠道发育、形态学和稳态中起着重要作用,而AP1转录因子在细胞增殖、分化、炎症、转化、细胞迁移和凋亡中起着关键作用。
GO分析显示在CNV小鼠中上调表达的300个基因主要富集在“小鼠结肠炎”、“人类炎症性肠病”和“人类衰老”等功能(图1e)。对这三类上调基因的检测表明,暴露于共生微生物群会导致LMR去甲基化和一组早期炎症基因(即“前哨炎症基因”)的转录激活,这些前哨炎症基因可能会驱动正常的肠道内稳态,这组基因包括IFITM3(上调2.9倍)、NOS2(上调15.6倍)和PLA2G2A(上调15.5倍),它们都是由微生物引起的,参与抗菌和抗炎反应。

图1从GF小鼠和CNV小鼠分离的结肠隐窝细胞的WGBS测序
CNV小鼠急性结肠炎诱导DNA低甲基化
给药葡聚糖硫酸钠(DSS)可改变肠粘液层,使细菌在12小时内渗入内层。因此,我们用DSS治疗小鼠,以增强肠上皮细胞(IECs)对微生物群的暴露,正如预期的那样,DSS治疗的小鼠表现出各种肠道损伤和炎症症状(图2a-f)。然后我们使用WGBS详细分析了DSS相关的DNA甲基化变化,结果表明,在DSS处理的CNV样品(图2g)中,特别是在层板相关结构域LAD(LADs形成了一种染色质抑制状态,有几千个基因位于LADs内,其中大部分基因都处于转录失活状态)中,整体甲基化水平降低。这些结果表明,单剂量DSS处理会导致基因组具有大的低甲基化区域,这些区域与后期复制结构域(部分甲基化结构域(PMDs))相关。
对WGBS(GF小鼠VS CNV小鼠肠上皮细胞)和RNA-seq(GF小鼠VS CNV小鼠肠上皮细胞)数据集(在3个生物复制体上进行)的综合分析确定了251个启动子,它们改变了甲基化水平,并显著改变了相关基因的表达水平(大于2倍)。值得注意的是,这些基因中的大多数(185)在DSS处理的CNV小鼠中被激活,并且这些基因含有在急性炎症中发生低甲基化的启动子。有趣的是,通路分析显示,上调的低甲基化基因主要富集在免疫细胞趋化性和炎症反应等重要功能方面。FACS和RNA-seq显示DSS样本中免疫细胞的贡献率较低,提示观察到的基因表达变化可能是IECs的表观遗传重塑所致。

图2 急性炎症中甲基化变化对基因表达的影响
急性结肠炎引起表观遗传调控因子的深刻变化
为了进一步解释依赖于CNV/DSS的变化,我们分析了LMR甲基化水平,在131133个LMR中,20061个在CNV/DSS样本中高甲基化(甲基化差异>0.1),而14585个低甲基化。当从分析中排除分化相关的LMR时,得到了非常相似的结果(图2h),表明分化相关的LMR对炎症诱导的甲基化变化没有显著贡献。炎症相关的甲基化变化通常延伸到LMR的整个长度(图2i)。最后,差异甲基化的LMR对于增强染色质标记H3K4me1和H3K27ac(大多数H3K4me1修饰富集在增强子区域,H3K27ac主要富集在增强子和启动子区域,当增强子区只有H3K4me1修饰富集时,该增强子处于平衡状态,而当增强子区域同时富集H3K4me1和H3K27ac修饰时,该增强子就处于激活状态促进基因表达)明显富集,而对于活性启动子标记H3K4me3(H3K4me3在转录起始位点下游的出现有明显峰值,而这高峰值也一直被认为与基因表达调控息息相关)则强烈缺失(图2j),总之,这些结果表明急性炎症在特定增强剂区域诱导了深刻的表观遗传变化。进一步分析发现,在DSS处理的CNV小鼠中,373个基因的一个子集的表达显著上调,并且LMRs发生了低甲基化,这些基因显示了免疫反应途径的显著富集(图2k)。
与差异表达基因相关的LMRs显著富集在多种预测转录因子结合位点,包括两种炎症反应的典型因子:NF-κB和AP1(图2l,m)。NF-κB结合位点在与上调基因相关的低甲基化LMRs中富集3.4倍,在与下调基因相关的低甲基化LMRs中富集5.5倍,这与NF-κB作为转录激活因子和抑制因子的双重功能一致;高甲基化LMRs则没有富集现象,这与选择性炎症诱导的NF-κB与低甲基化LMRs的结合一致。AP1结合位点在与上调基因相关的低甲基化LMRs中富集11.3倍,在与下调基因相关的低甲基化LMRs中富集8.8倍,这与NF-κB作为转录激活因子和抑制因子的双重功能一致;高甲基化LMRs的类似富集情况则没有发现,这与选择性炎症诱导的NF-κB与低甲基化LMRs的结合一致,同样,高甲基化LMRs也没有富集现象。DSS在含有NF-κB或AP1结合位点的LMR处诱导的低甲基化非常明显,并延伸到LMR的整个长度。因此,由粘膜屏障破坏引起的急性炎症在增强子区域引起广泛的甲基化改变,这与主要炎症转录网络的活性改变有关。
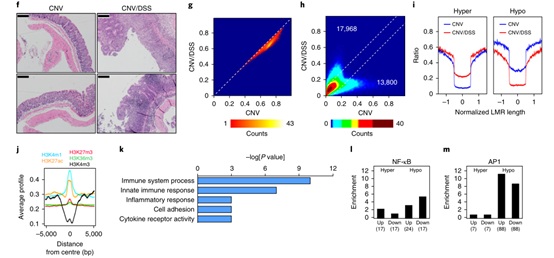
图2 急性炎症中甲基化变化对基因表达的影响
急性炎症CNV小鼠开放染色质、甲基化和基因表达数据的重叠
由于表达通常与开放染色质的局部变化相关,我们进行了全基因组的ATAC-seq分析,在CNV小鼠中鉴定出469个显著差异峰,在DSS/CNV-IECs中鉴定出21925个显著差异峰。在后者中,4122个与低甲基化CNV/DSS特异性LMRs重叠(图3a),后者与391个显著上调的基因相关。这些基因在小鼠(图3b)以及人类结肠炎和结肠癌(图3c)的急性和先天性炎症反应中富集,证实了全基因组甲基化分析。

图3 小肠结肠炎的ATAC-seq分析
值得注意的是,AP1转录因子结合位点在这些ATAC-seq峰中高度富集(图3d)。这组基因的一个例子是Myd88。它与DSS处理的CNV小鼠中的低甲基化LMR、DSS特有的ATAC-seq峰和活化表达有关(图3e)。Myd88作为Toll样受体信号传导途径的下游转接器蛋白参与细菌的感知和功能,包括已知与细菌脂多糖(LPS)相互作用的TLR4。因此,我们的研究结果表明,宿主肠上皮基因的微生物群相关调控与染色质开放有关。

图3 小肠结肠炎的ATAC-seq分析
急性炎症不依赖于微生物群
为了找出CNV/DSS中观察到的表观遗传变化是否是由于细菌暴露引起的,我们用DSS处理GF小鼠从而引起肠道损伤和炎症(图4a-c)。RNA-seq数据分析仅发现193个基因在GF/DSS和GF样本中表达水平发生显著变化:114个基因上调,79个基因下调。这些基因与部分在DSS处理CNV小鼠中上调和下调的基因共享(图4d),这表明DSS依赖的“核心”效应。相比之下,CNV/DSS小鼠中只有5%的基因受到GF/DSS小鼠的影响。这表明DSS处理中观察到的相当大的表达变化是由微生物群引起的。
为了研究在没有微生物群的情况下与DSS处理相关的甲基化变化,再次进行了WGBS测序,排除与分化相关的LMRs后,我们在GF/DSS样品中鉴定出7388个高甲基化LMRs,与未处理的GF小鼠相比,鉴定出5628个低甲基化LMRs(图4e)。WGBS分析的结果通过靶向亚硫酸氢盐甲基化分析得到证实,并且结果进一步强调在CNV/DSS小鼠中观察到的变化在GF/DSS小鼠中不存在。后将单个LMRs分配给特定基因后,发现只有39个LMRs在DSS处理的GF小鼠中变得低甲基化,并且显示出显著的表达增加,在DSS处理的GF小鼠中,94个LMRs发生了高甲基化,并显示出显著的表达降低。这些结果证实了DSS在没有微生物群的情况下有相当温和的效果。此外,当将在GF/DSS中改变的LMRs的相关基因与在CNV/DSS中改变的LMRs的相关基因进行比较时,我们仅识别出44个重叠基因(图4f)。这些结果表明,DSS处理在没有微生物群的情况下产生了非常小的DNA甲基化依赖性的表达变化。
最后,为了解决出生后DNA甲基化与肠道微生物群之间的直接联系,我们进行了粪便移植实验,使GF小鼠常规化,同时将其保存在无菌隔离器中,重新建立共生微生物群后会显著降低DNA甲基化(图4g)。这些发现证实了微生物群在稳态和炎症条件下观察到的表观遗传规划效应中的关键作用。

图4无微生物群时炎症结肠的基因表达和甲基化变化
微生物群诱导去甲基化的分子机制
胚胎发生早期的去甲基化是由TET酶的组合介导的,TET酶羟基化5mC。为了测试微生物群诱导的结肠去甲基化是否以类似的方式完成,我们最初分析了从CNV小鼠结肠隐窝IECs分离的RNA序列数据,发现TET1不表达,而TET2和TET3(TET2/3)表达。然后,我们检测了来自GF和CNV的结肠隐窝IECs的TET2/3表达水平是否存在差异。事实上,TET3(而不是TET2)在CNV中的表达明显高于GF。此外,用抗生素治疗CNV小鼠可将TET3表达降低至GF水平,而DSS治疗小鼠和LPS治疗结肠有机物可上调TET3表达水平,将肠道微生物群与TET3表达联系起来。
因此,在随后的实验中,我们将Tet2/3fl/fl小鼠与肠特异性绒毛蛋白启动子驱动的表达CRE重组酶的动物杂交,从而获得在肠上皮中这些酶的组织特异性敲除小鼠(Tet2/3 fl/fl VillinCre)。然后我们从指定野生型(Tet2/3 fl/fl)和Tet2/3 fl/fl VillinCre 敲除小鼠的结肠中分离出隐窝IECs,并进行WGBS,结果表明,Tet2/3 fl/fl VillinCre 敲除小鼠的整体甲基化水平显著升高(图5a),在6个微生物群诱导的低甲基化LMRs(图5b)上通过靶向亚硫酸氢盐测序进一步验证了这一点。这些结果表明TET2/3在微生物诱导的脱甲基过程中起着关键作用。
对Tet2/3 fl/fl VillinCre 敲除小鼠中六个与高甲基化LMRs相关的基因的RT-PCR分析表明,在所有突变动物中,三个基因的转录显著降低(图5c),表明TET2/3介导的这些调控序列的去甲基化在基因诱导中起直接作用。另外三个基因在突变小鼠中则显示出可变的表达,这表明这些LMRs要么不调节其相关基因,要么涉及额外的调节因子。
为了研究TET2/3缺失是否抑制去甲基化反应,我们对5个DSS诱导的低甲基化LMRs进行了靶向亚硫酸氢盐测序,结果表明,与Tet2/3 fl/fl小鼠相比,DSS处理的Tet2/3 fl/fl VillinCre小鼠的所有受试LMRs均未能去甲基化(图5d)。此外,Tet2/3 fl/fl VillinCre突变体比Tet2/3fl/fl小鼠更易受DSS处理的影响,如疾病活动、体重减轻和组织学分析所证明(图5e-h),这与TET2/3介导的微生物依赖性去甲基化以及突变小鼠对炎症挑战的反应低于野生动物的观点一致。

图5 微生物群诱导去甲基化的分子机理