在往期的分享中我们曾介绍过单核转录组测序(snRNA-seq)的应用和优势(单核转录组测序:一定程度上解决单细胞样本处理难度),从目前的文献检索结果来看,单核转录组测序已经被广泛用于脑组织、心脏组织、肾脏组织以及多种类型肿瘤组织的研究中。值得注意的是10xGenomics公司的Chromium系统也能很好地应用于单细胞核样本的建库过程中,应用10xGenomics平台进行单核转录组建库测序的文章也是越来越多,其中2020年4月27日Nature Neuroscience杂志在线背靠背发表了2篇应用单核转录组测序的研究论文。

第一篇文章利用单核转录组测序在阿尔茨海默症(AD)小鼠模型中发现了一群疾病相关联的星形胶质细胞,这些细胞出现在疾病的早期阶段,并随着疾病进展其丰度会增加,并且在老化的野生型小鼠和老化的人脑中也发现了相似的细胞。
研究人员对7月龄的野生型(WT)或转基因AD小鼠模型(5xFAD)的海马利用单核转录组测序构建了细胞-分子图谱,共计8只小鼠的54,769个高质量的细胞核(图1A)。将这些细胞共分成23个簇(图1B),WT和AD之间大部分细胞显示出相似性,部分细胞群表现出差异性(图1C)。AD与WT相比星形胶质细胞状态有显著差异(图1C),AD小胶质细胞状态也有显著差异,其发生频率随疾病进展而增加(图1C),包括疾病相关小胶质细胞群(DAM)。AD周细胞/内皮细胞的频率增加(P < 0.01,图1C),而新近激活的锥体神经元减少(P < 0.01,图1C),一些罕见基质细胞群的频率也降低了(P < 0.01,图1C)。
AD和WT中的星形胶质细胞轨迹分析显示出连续变化的三种转录状态(图1D)。这些细胞分为6个转录子簇(图1D、E),AD和WT之间在不同状态下的细胞比例不同(图1F),只在AD中出现了一种独特的状态。在AD中发现了一种额外的星形胶质细胞Gfap高(Gfap-high)的状态,称之为疾病相关星形胶质细胞(DAA,图1F)。此外,cluster 5(在WT和AD中)表现出Gfap-low和Gfap-high状态之间的过渡样中间状态(cluster 6),而cluster 3在AD中频率显著增加(图1F),表现出Gfap-low状态和DAA之间的过渡样中间状态(cluster 4,图1D、E)。
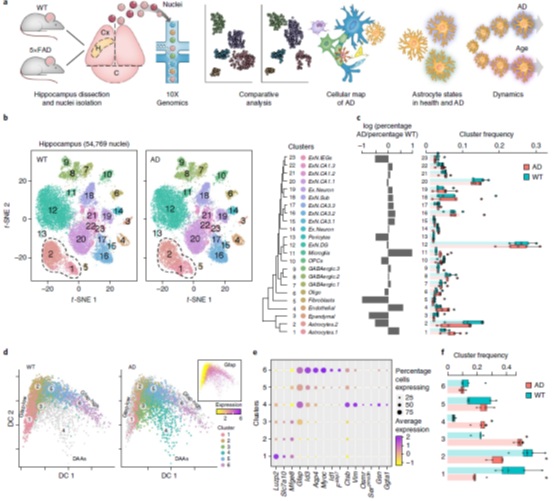
图1 海马区细胞图谱显示出AD中独特的DAAs
在WT和AD中观察到的Gfap-high星形胶质细胞群和AD中独特的DAA群与低Gfap-low星形胶质细胞相比,共享大量的上调的基因(图2A、B)以及少量下调的基因(图2A)。Gfap-high和DAA群中上调的基因参与发育和分化、代谢途径(脂类、胆固醇)、对有毒化合物的反应和炎症信号(图2B)。
为了将DAAs与以往描述的星形胶质细胞特征联系起来,对组织(bulk)数据RNA表达水平进行分析,发现与WT相比,AD星形胶质细胞总体上有泛反应和炎症/A1星形胶质细胞特征的表达增加,但没有显示缺血/ A2星形胶质细胞特征的增加(图2C)。在239个DAA特征基因和213个先前描述的DAM特征基因间有18个共享的基因,这些基因包括AD风险基因Apoe和Ctsb、Ctsd及Ctsl基因,编码与AD发病有关的蛋白(图2D)。研究人员为了验证在蛋白水平上DAA的存在,利用免疫荧光对WT和5xFAD模型中海马区相关marker蛋白进行染色,结果证实了一些marker的特异性(图2E-H)。
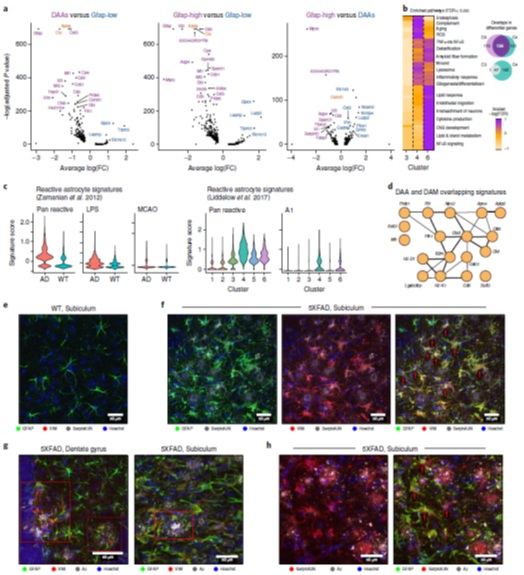
图2 DAAs与不同的分子途径相关联,在定位上靠近Aβ斑块
为了确定疾病进展过程中发生的变化,对不同年龄的AD和WT小鼠进行单核转录组分析(1.5-2、4-5、7-8、10、13-14和20个月大,28只小鼠,23,863个星形胶质细胞核;图3A)。据报道,从4个月开始,AD的小胶质细胞频率在所有测试时间点都高于WT,并随年龄增长而增加(图3B)。在WT小鼠(1.5-10个月大)和AD幼鼠(1.5-2个月大)中,星形胶质细胞沿着相同的连续轨迹分布,横跨Gfap-low到Gfap-high的状态(图3C)。然而,在AD中,从4个月大开始,在出现认知下降之前,Gfap-low星形胶质细胞一致减少,DAAs相应增加((图3D))。结果表明,在AD小鼠模型中,DAAs在认知功能下降前就出现,并随疾病进展而增加。
从扩散图(图1D、3C)可以看出,Gfap-low星形胶质细胞是Gfap-high星型胶质细胞和DAAs的潜在来源(图3C)。为了探索这种可能性,研究人员又设计了一个计算程序来推断细胞状态之间的转换,最终发现Gfap-low细胞是cluster 3中细胞的主要来源,cluster 3和cluster 5中的细胞是相邻时间点间DAAs的主要来源(cluster 4,图3E-G)。对不同时间点clusters间每个过渡态相关的高表达基因进行提取,这些高显著性基因揭示了一组独特的DAA标记(图3H),这与差异表达的分析一致(图2A)。
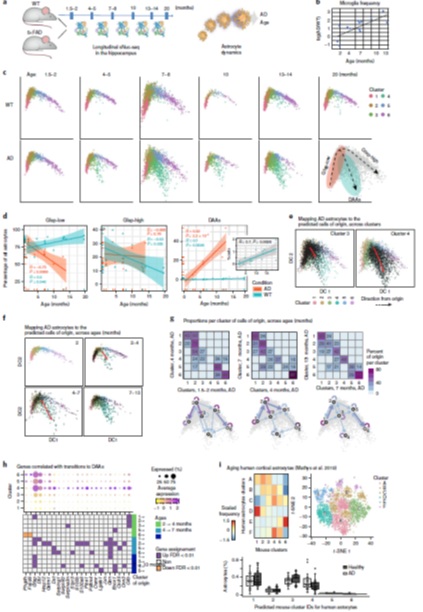
图3 DAAs来源于内稳态的Gfap-low星形胶质细胞并随年龄增长

第二篇文章则是利用单核转录组测序技术在重度抑郁症患者的前额皮质中发现了少突胶质细胞前体细胞和兴奋性神经元。
重度抑郁症(MDD)对全球性疾病负担有巨大影响,影响着全世界数百万人,近30年来一直是导致残疾的主要原因。过去对MDD的分子研究使用的是死后脑组织的大块匀浆,这掩盖了单个细胞类型中的基因表达变化。因此这项研究使用单核转录组来检测男性MDD患者(n = 17)和健康对照组(n = 17)的背外侧前额皮质的约80,000个核。最终确定了26种细胞簇,其中超过60%的细胞簇在组间表现出不同的基因表达。进一步发现,最严重的失调发生在深层兴奋性神经元和未成熟少突胶质细胞前体细胞(OPCs),这些细胞几乎贡献了所有基因表达变化的一半(47%)。这些结果突出了解剖细胞类型特异性对该病贡献的重要性,并为确定新的研究途径和新的治疗目标提供了机会。
文章的实验设计如图1所示,对34例前额皮质样本进行单核转录组测序和分析后,分别利用FANS(荧光辅助的核分选)高通量qPCR和RNAScope荧光原位杂交对差异表达结果进行验证。
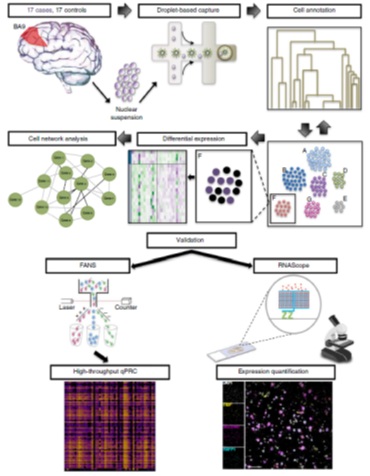
图1 实验设计流程
对背外侧前额皮质的细胞核基因表达数据进行分析共发现26种不同的细胞类型,主要包括兴奋性/抑制性神经元,星型胶质细胞,少突胶质细胞,少突胶质细胞前体细胞,内皮细胞和小胶质细胞等(图2),并对少突胶质细胞进行了发育轨迹重建(图2E)。
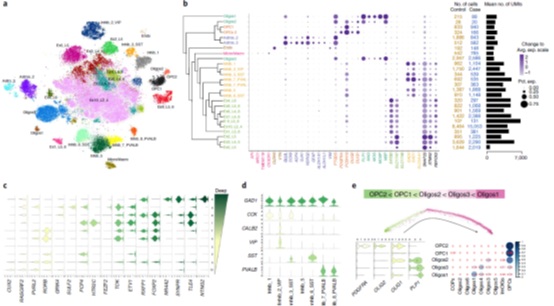
图2 细胞类型识别
然后将实验组和对照组每个cluster进行基因表达差异分析,25个cluster中16个cluster共计96个基因存在差异表达(FDR < 0.10,图3A),除了1个cluster外所有的抑制性神经元cluster均有差异基因,而非神经元的cluster中既有上调也有下调的基因(图3B)。特别的是,两个cluster——未成熟的OPCs(OPC2)和深层兴奋性神经元(Ex7)占据了近一半(47%)的差异表达基因(图3C)。作者并将自己的数据与以往的发现进行了比较(图3D、E)。
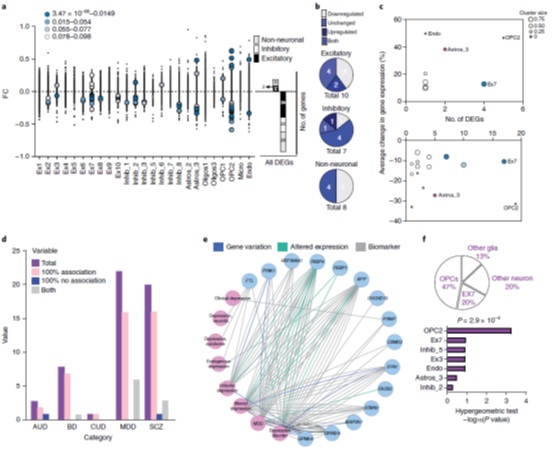
图3 差异表达基因分析
进一步对细胞类型特异性的差异表达基因进行功能富集分析以及加权基因共表达网络分析(WGCNA),并对差异表达基因进行FANS qPCR验证。随后对cluster之间进行配体和受体关联分析,利用RNAScope荧光原位杂交技术对选择的marker基因进行验证。具体内容和结果详见原文。
关于天昊
天昊生物已经完成包括神经组织、肾脏组织和心脏组织在内的多种类型样本的单细胞核文库制备和测序,期待与您的合作!