2020年7月我们精选了m6A RNA甲基化研究领域IF > 7的6篇文献供大家阅读欣赏:


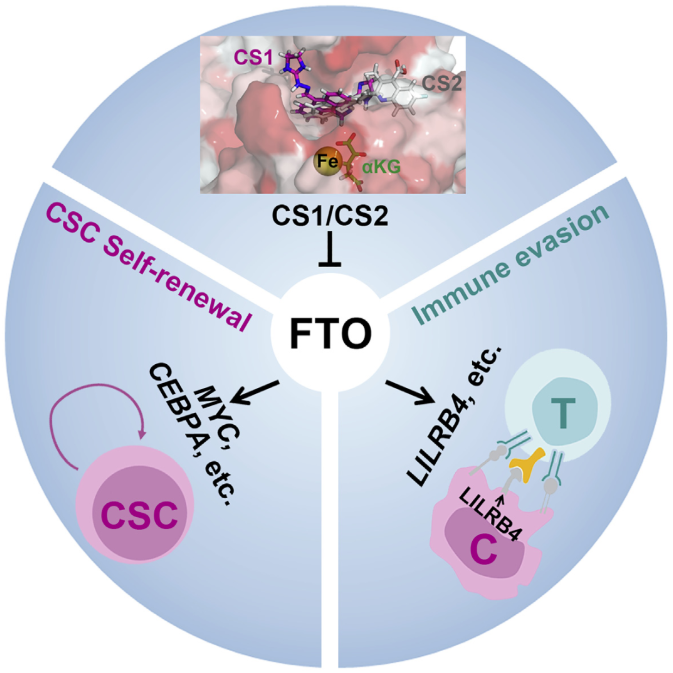
美国希望之城贝克曼研究所陈建军课题组针对m6A去甲基化酶FTO开发了两种有效的小分子抑制剂。FTO抑制通过限制癌症干细胞的自我更新和抑制免疫逃逸在几种类型癌症的小鼠模型中均显示出抗肿瘤作用。在此之前已经发现了多个特异性或非特异性的FTO抑制剂,包括R-2HG、MO-I-500等,但是这些小分子由于生物学功能温和,敏感性和/或特异性较低,临床潜力有限。研究人员对26万种化合物通过基于结构的虚拟筛选及验证确定了CS1和CS2能够选择性结合并占据FTO的催化口袋,从而阻断m6A修饰的寡核苷酸进入口袋,因此实现对FTO去甲基化酶活性的抑制。
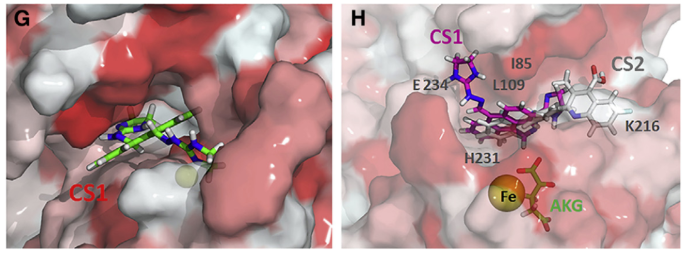
体外实验证实了CS1和CS2作为高效的FTO抑制剂,并且具有显著的抗白血病疗效。FTO抑制剂能够显著增加AML细胞凋亡及细胞周期阻滞,而且能够有效地抑制白血病干细胞/起始细胞的自我更新。进一步通过RNA-seq发现FTO抑制或knockdown可能激活了“Apoptosis”信号通路,并抑制了“MYC targets V1”和“MYC targets V2”通路,从而实现对细胞凋亡和细胞周期的调控。体内的实验也显示出CS1和CS2的抗白血病功效。联系到FTO/m6A信号轴,作者发现FTO通过抑制YTHDF2介导的m6A修饰的LILRB4 mRNA稳定性实现对LILRB4表达的正向调控,进一步研究揭示靶向FTO/m6A/LILRB4能够使白血病细胞对T细胞毒性敏感,并克服低甲基化试剂诱导的免疫逃逸。因此这项研究表明FTO在癌症干细胞自我更新和免疫逃逸中发挥了重要作用,并强调了靶向FTO治疗癌症的广泛潜力。


双链断裂(DSBs)是最有害的DNA损伤,如果不修复,可能会导致基因组不稳定或细胞死亡。这项研究报道了为应对DSBs,RNA甲基转移酶METTL3在S43位点被ATM介导的磷酸化激活。然后磷酸化的METTL3被定位到DNA损伤部位,在DNA损伤相关RNA中使得腺嘌呤N6位置发生甲基化修饰,进而招募m6A读蛋白YTHDC1进行保护。这样,METTL3-m6A-YTHDC1信号轴调控DSBs位点DNA-RNA杂合体的积累,然后招募RAD51和BRCA1进行同源重组(HR)介导的修复。而METTL3缺陷的细胞则表现出HR缺陷、未修复的DSBs积累和基因组不稳定。因此,METTL3缺失可显著提高癌细胞和小鼠异种移植模型对基于DNA损伤治疗的敏感性。这些发现揭示了METTL3和YTHDC1在HR介导的DSB修复中的作用,可能对癌症治疗有重要意义。


T细胞METTL14缺失能够诱发小鼠自发性结肠炎。其特征是炎症细胞浸润增加,结肠重量/长度比增加,Th1和Th17细胞因子增加。结肠炎的发展是由于功能失调的调节性T (Treg)细胞,因为野生型Treg细胞过继转移减弱了结肠炎的表型。与野生型对照相比,METTL14缺陷Treg细胞降低了RORγt表达。METTL14缺陷导致naïve T细胞向诱导Treg细胞的诱导受损。抗生素治疗明显地减轻了结肠炎的发展。因此这项研究报道了基于干扰T细胞RNA甲基化的自发性结肠炎小鼠新的模型。结肠炎是T细胞介导的,并依赖于微生物组。这个模型可以为阐明致病途径,研究肠道微生物组的贡献和炎症性肠病治疗药物的临床前测试提供新的工具。


表观遗传改变发生在许多生理和病理过程中。m6A修饰是真核mRNA中最常见的修饰。然而,m6A修饰在病理性血管生成中的作用仍不清楚。这项研究发现缺氧应激后,内皮细胞和小鼠视网膜中m6A修饰水平显著上调,这是由METTL3水平升高引起的。METTL3的沉默或过表达改变了体外内皮细胞的生存能力、增殖、迁移和管腔的形成。体内METTL3敲除降低了氧诱导视网膜病变模型的无血管区和病理性新生血管簇,抑制了碱烧伤诱导的角膜新生血管形成。机制上,METTL3通过m6A修饰靶基因(如LRP6和DVL1)来调控Wnt信号通路,发挥血管生成作用。METTL3增强了LRP6和DVL1的翻译,依赖于YTHDF-1。综上所述,本研究提示METTL3介导的m6A修饰是一种重要的缺氧应激反应机制。通过写蛋白METTL3靶向m6A是治疗血管生成性疾病的一项极有前景的策略。


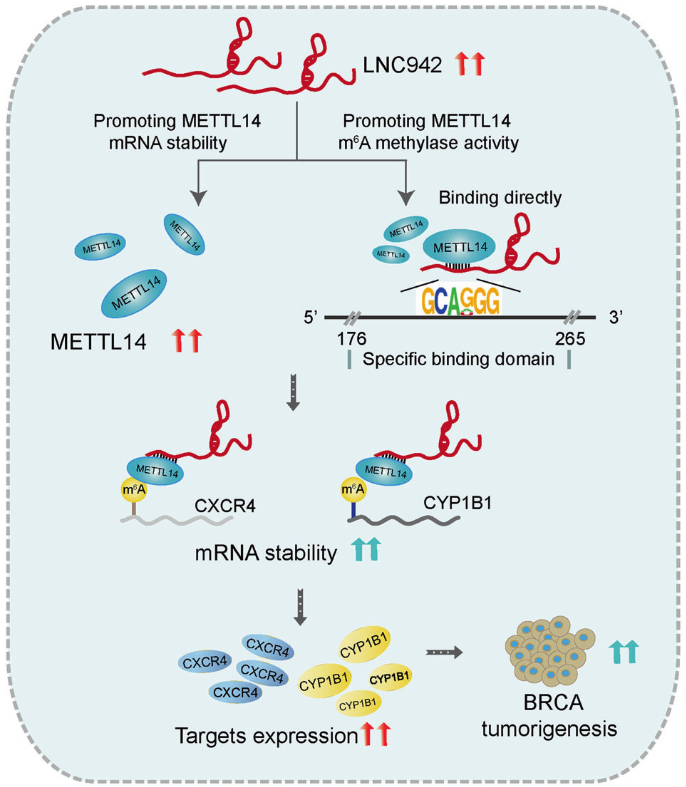
越来越多的证据支持lncRNAs在m6A表观遗传修饰水平作为肿瘤发生和发展的主调控因子。然而,乳腺癌(BRCA)的潜在调控机制仍不清楚。这项研究揭示了LINC00942 (LNC942)作为癌基因,在BRCA的起始和发展过程中,促进METTL14介导的m6A甲基化,调控其靶基因CXCR4和CYP1B1的表达和稳定性。具体来说,LNC942和METTL14在BRCA细胞和纳入的BRCA组(n = 150)中显著上调,同时伴有m6A修饰水平的上调。功能上,LNC942可诱发强的致癌作用,促进细胞增殖和菌落形成,抑制细胞凋亡,进而提高BRCA细胞中METTL14介导的m6A甲基化水平及其CXCR4、CYP1B1相关的mRNA稳定性和蛋白表达。机制上,LNC942通过具有特异性识别序列(+176—+265)直接招募METTL14蛋白,从而通过转录后m6A甲基化修饰在体内外稳定LNC942下游靶点CXCR4、CYP1B1的表达。因此,这项研究结果揭示了一个新的LNC942-METTL14-CXCR4/CYP1B1信号轴,为BRCA的防治提供了新的靶点和交互m6A表观遗传修饰机制。


恶性胶质瘤是成人致死性的原发性脑瘤之一。如此糟糕的预后要求我们更好地理解这种疾病的癌症相关信号通路。这项研究阐明了在胶质瘤中调节增殖和肿瘤发生的一个MYC-miRNA-MXI1反馈回路。MYC通过miR-155和miR-23a簇抑制MXI1的表达,而MXI1则通过与MYC启动子结合抑制其表达。过表达miR-155和miR-23a簇促进U87胶质瘤细胞的肿瘤发生。此外,m6A RNA去甲基化酶FTO通过靶向MYC调节这一回路。甲氯灭酸乙酯(MA2)抑制FTO,增强化疗药物替莫唑胺(TMZ)抑制胶质瘤细胞增殖的作用,并负向调节回路。这些数据共同强调了胶质瘤的一个关键调节回路,并为临床治疗提供了潜在的靶点。

往期相关链接:
Cell报道YTHDF蛋白调控m6A新的作用模式!; 2020年2月m6A RNA甲基化研究总结;

天昊生物具有多年基因组、转录组和表观组等多组学检测与分析的经验,m6A RNA甲基化作为表观领域的一大热点,天昊生物自主设计了m6A调控因子(writers/erasers/readers)差异表达分析检测panel,还可以提供m6A修饰整体水平定量检测,并结合MeRIP-seq和RNA-seq挖掘受m6A调控因子影响的下游靶点,同时可对相关的靶点进行MeRIP-qPCR验证。生信团队亦可提供个性化的m6A数据库挖掘与生信分析内容。
